الخلية الجلفانية
وتسمى كذلك الخلية الكهروكيميائية أو الخلية الفولتية. وهي بطارية اخترعها العالم الإيطالي الأستاذ لويجي جلفاني أستاذ الطب في جامعة بولونيا واكتشفها مصادفة سنة 1786 أثناء تجاربه حول فعل الكهرباء على عضلات الضفادع حيث لاحظ ارتعاش الضفدع في إحدى تجاربه عندما لمس طرفاه معدنين مختلفين في دائرة كهربائية مكتملة، وظن عندها ان مصدر الكهرباء يرجع إلى كهرباء حيوانية
إلى أن جاء أستاذ الفيزياء أليساندرو فولتا الذي عزى ظهور الكهرباء إلى أن المعدنين مختلفين، واستطاع فولتا فيما بعد أن يصنع بطارية من هذا النوع وسميت هذه الخلايا باسم أول من اكتشف تلك الظاهرة وهو جلفاني.
محتويات |
وصف الخلية الجلفانية
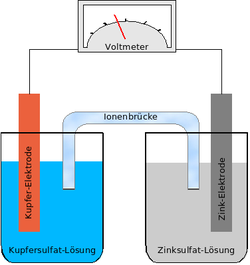
تتكون الخلية الجلفانية من نصفي خليتين. في كل واحدة منها يغطس قطب معدني مختلف عن الأخر، وكما في الشكل أحد القطبان من معدن الخارصين Zn والآخر من النحاس Cu. ويغطس كل منهما في محلول لأحد أملاحه : الخارصين في محلول كبريتات الخارصين ZnSO4 ولوح النحاس في محلول كبريتات النحاس CuSO4. والخاصية الكيميائية هنا أن ذرات المعدن لها ميل لترك المعدن والدخول في المحلول، وهي عندما تفعل ذلك فإنها تترك إلكترونات على اللوح وتدخل المحلول على هيئة أيونات موجبة الشحنة. وكل من أنصاف الخليتين له تفاعله مع محلوله. وهذا النظام يسمى باسم أول من أخترعه دانيل وتسمى تلك الخلية خلية دانيال.وكما في الشكل نجد أن ذرات الخارصين Zn لها ميل أكبر لدخول محلولها عن ذرات النحاس Cu. أي أن تراكم الإلكترونات على لوح الخارصين يكون أكبر من تراكمها على لوح النحاس. وبما أن الإلكترونات ذات شحنة سالبة يتكون على لوح الخارصين جهدا كهربي سالب الشحنة أكبر من الجهد الكهربي على لوح النحاس. ونظرا لعدم وجود توصيلة خارجية بين القطبين فلا يسير تيار ولا تنتقل الإلكترونات.
وعندما نوصل القطبين من الخارج (بفولتمتر كما في الشكل) تبدأ الإلكترونات الانتقال من القطب Zn الأكثر سالبية إلى قطب النحاس Cu الأكثر إيجابيا (الموجب). ونظرا لأن الإلكترونات ذات شحنة سالبة ينتج تيار كهربائي يسير في عكس اتجاه الإلكترونات. كما يسير في نفس الوقت في المحلول تيار من الأيونات بنفس شدة التيار الخارجي. وتدخل لكل إلكترونين يغادرين قطب الخارصين في الدائرة الخارجية إلى قطب النحاس، تدخل ذرة خارصين Zn في المحلول على هيئة أيون موجب Zn2+ وذلك لتعويض الإلكترونين اللذان تركا لوح الخارصين من الخارج.
وطبقا للتعريف فالمصعد anode هو القطب الذي تحدث عليه الأكسدة (افتقاد إلكترونات)، وعليه ففي الخلية الجلفانية يمثل قطب الخارصين المصعد. ونظرا لأن النحاس قد اكتسب إلكترونين عن طريق التوصيلة الخارجية، يقوم هوالآخر بإعطاء إلكترونين إلى أيون نحاس Cu2+ من محلول كبريتات النحاس فيتعادل ايون النحاس ويترسب على لوح النحاس. وبحسب التعريف فالمهبط cathode هو القطب الذي يحدث عليه الاختزال (أي اكتساب إلكترونات)، فقطب النحاس هو المهبطد cathode. وتسير الإلكترونات من المصعد إلى المهبط في الدائرة الخارجية.
حساب القوة الدافعة الكهربية
يمكن تعيين فرق الجهد للخلية الكهربائية (القوة الدافعة الكهربية) بواسطة جدول جهد القطب القياسي للعناصر وذلك لكلا من نصفي الخلية. ونفترض عند اجراء هذا التعيين أن التيار المار بين قطبي الخلية يساوي صفرا.نبدا أولا باختيار المعدنين. ونبحث في الجدول القياسي standard electrode potential عن الجهد القياسي لكل من المعدنين E
وعلى سبيل المثال ففي الشكل أعلاه لدينا محلولين كبريتات النحاس وكبريتات الخارصين، وينغمس لوح نحاس في كبريتات النحاس كما ينغمس لوح خارصين في محلول كبريتات الخارصين. كما توجد قنطرة بين المحلولين (وهذه يمكن الاستعاضة عنها بغشاء فاصل بين المحلولين) تسمح بمرور أيونات SO42− من محلول النحاس إلى محلول الخارصين (وبذلك تتم الدائرة الكهربية عند توصيل اللوحين من الخارج بموصل.)
لدينا نصفي خلية، واحدة للنحاس Cu والأخرى للخارصين Zn، والتفاعلان الجاريان هما :
التفاعل عند المصعد:
- Zn → Zn2++ 2e- (E = -0.76 V)
- Cu2+ + 2e- → Cu (E = +0.34 V)
وحصلنا لنصف خلية النحاس على الجهد E = +0.34 V ولنصف خلية الخارصين على الجهد E = -0.76 V من الجدول القياسي. أي أن التفاعل الكلي الجاري في الخلية :
- Cu2+ + Zn → Cu + Zn2+
- +0.34 - (-V 1.100 = (0.76
فرق الجهد عند تشغيل بطارية
العلاقة بين فرق الجهد والقوة الدافعة الكهربية (electromotive force (e.m.fنفترض بطارية E قوتها الدافعة الكهربية 12= E فولت ومقاومتها الدخلية 2 أوم، وُصلت بمقاومة خارجية 6 أوم ومفتاح.
فرق الجهد بين طرفي البطارية والمفتاح مفتوح (لا يمر تيار):
- فولت 12 = V = E
- أمبير (I= E ÷(R+r
- E القوة الدافعة الكهربية للبطارية
- R المقاومة الخارجية
- r المقاومة الداخلية للبطارية
- أمبير 1.5 =(I= 12 ÷(6+2
- V=E-I.r
- فولت 9 = 2.5 وV= 12 -1
الاتجاه الاصطلاحي للتيار الكهربي
يُعبّر التيار الكهربي عن مرور فيض من الشحنات الموجبة في موصل من القطب الموجب (المهبط)إلى القطب السالب (المصعد). وهذا مااصطلح عليه العلماء منذ زمن بعيد، وذلك لأن اكتشاف الكهربية التيارية حدث قبل اكتشاف الإلكترونات، فقد اصطلح على ذلك.الإتجاه التقليدي الاصطلاحي : اتجاه التيار في الدائرة الخارجية من القطب الموجب إلى القطب السالب للبطارية.
الاتجاه الإلكتروني : من القطب السالب (الغني بالالكترونات) إلى الموجب (الفقير بالإلكترونات) خارج البطارية.
الشغل المبذول في الكهرباء
الشغل المبذول هو الشغل اللازم بذله لنقل كمية كهربية مقدارها 1 كولوم بين نقطتين بينهما فرق جهد. ويقاس الشغل بوحدة جول، حسب العلاقة :- W = Q x V
W الشغل جول
Q كمية الكهرباء كولوم
V فرق الجهد فولت
ومن تلك العلاقة يمكن تعريف الفولت:
الفولت هو فرق الجهد بين نقطتين عندما يلزم يذل شغل مقداره 1 جول لنقل كمية كهربية مقدارها 1 كولوم من إحدى النقطتين إلى الأخرى.
1 جول = 1 كولوم x فولت
نقلا / عن موقع ويكبيديا الموسوعة الحرة

ليست هناك تعليقات:
إرسال تعليق